Aufbau princips ir pamatmetode, kas mums parāda, kā elektroni tiek piepildīti atomu orbitālē. Saskaņā ar Aufbau principu elektronu piepildīšanās atoma pamatstāvoklī notiek pēc pamata shēmas. Šis princips norāda, ka elektroni jebkura atoma atomu orbitālē ir piepildīti to enerģijas augošā secībā un, lai atrastu atomu orbitāles enerģiju, tie ievēro n+l likumu.
Struktūras princips
Šajā rakstā mēs detalizēti uzzināsim par Aufbau principu, Aufbau principa iezīmēm, tā izņēmumiem un ierobežojumiem.
java virkne cmp
Struktūras principa definīcija
Aufbau princips to nosaka
Elektroni dažādās orbitālēs tiek piepildīti to enerģijas pieaugošā secībā, t.i., orbitāle ar zemāko enerģiju tiks piepildīta vispirms un orbitāle ar lielāko enerģiju tiks aizpildīta pēdējā.
Vārds “Aufbau” vācu valodā nozīmē “celšanās”. Orbitāļu veidošanās nozīmē orbitāļu piepildīšanu ar elektroniem. Tajā teikts, ka elektroni atomu orbitālēs ir piepildīti atomu orbitāles enerģijas augošā secībā. Un atomu orbitāles enerģiju aprēķina, izmantojot n+l noteikumu, kas nosaka, vai elektronam ar lielāku n+l vērtības skaitli ir lielāka enerģija. Noteikumā, kas tika apspriests iepriekšējā rindā, n pasaka galveno kvantu skaitli un l norāda azimutālo kvantu skaitli.
Ja diviem elektroniem ir vienāda vērtība n+l, tad elektronam ar mazāku vērtību n ir mazāka enerģija, un tā tiek piepildīta vispirms. Tālāk ir apskatīta elektronu aizpildīšanas secība atomu orbitālē.
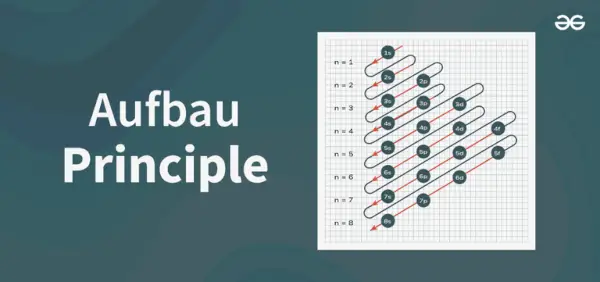
Principu diagrammas uzbūve
Aufbau principa diagramma ir diagramma, kas attēlo elektronu piepildīšanas secību atomā.
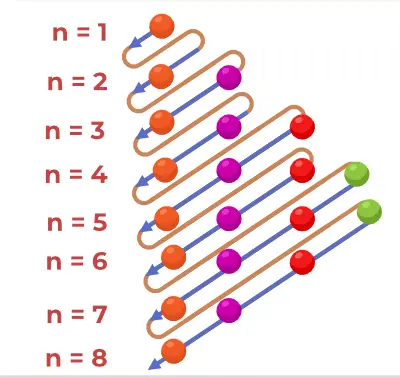
Principu diagrammas uzbūve
Principiālās formulas struktūra
Aufbau principa formula ir formula, kas norāda secību, kādā elektroni ir piepildīti atoma orbitālē. Atomu orbitālās formulas ir
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
11. principu klases uzbūve
Aufbau princips ir svarīgs ķīmijas princips 11. klases skolēniem. Šis princips nosaka, ka
Elektroni atoma orbitālē tiek aizpildīti augošā secībā pēc atoma orbitāles enerģijas, ko aprēķina, izmantojot (n+l) noteikumu.
Struktūras diagrammas zīmēšana
Aufbau diagramma tiek uzzīmēta, izmantojot tālāk pievienotās darbības,
- Atrodiet elektronu skaitu, kas jāaizpilda atomos.
- Mēs zinām, ka atomā
- s-orbitāle var saturēt ne vairāk kā 2 elektronus.
- p-orbitāle var saturēt ne vairāk kā 6 elektronus.
- d-orbitāle var saturēt ne vairāk kā 10 elektronus.
- f-orbitāle var saturēt ne vairāk kā 14 elektronus.
- Aizpildiet pirmos divus elektronus 1s orbitālē.
- Pēc tam izpildiet n+l noteikumu un pēc tam attiecīgi aizpildiet elektronus.
Struktūras principa galvenās iezīmes
Dažādas Aufbau principa iezīmes ir:
- Orbitāles enerģija ir atkarīga no galvenā kvantu skaitļa (n) un azimutālās summas skaitļa (I) vērtību summas. To sauc par (n + l) noteikums . Saskaņā ar šo noteikumu,
- Neitrālā izolētā atomā, jo zemāka ir (n + l) vērtība orbitālei, jo zemāka ir tā enerģija. Tomēr, ja divu dažādu veidu orbitālēm ir vienāda vērtība (n + l), tad orbitālēm ar mazāku vērtību n ir mazāka enerģija.
| Orbitāles veids | n vērtība | Vērtība l | Vērtība n+l | Relatīvā enerģija |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Zemākā enerģija |
| 2s | 2 | 0 | 2+0 = 2 | Lielāka enerģija nekā 1s orbitāle |
| 2p 3s salīdzināt ar java metodi | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitālēm(n=2) ir mazāka enerģija nekā 3s(n=3) orbitālei. |
| 3p 4s | 3 4 masīva kārtošana java | 1 0 | 3+1 = 4 4+0 = 4 | 3p orbitālēm(n=3) ir mazāka enerģija nekā 4s(n=4) orbitālēm. |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitālēm(n=3) ir mazāka enerģija nekā 4p(n=4) orbitālēm. |
No tabulā sniegtā apraksta izriet, ka dažādu orbitāļu enerģijas palielinās, palielinoties galvenā kvantu skaitļa skaitam.
- Tādējādi secība, kādā elektroni ir piepildīti atomu orbitālē atoms ir, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Elektroniskā konfigurācija, izmantojot Aufbau principu
The elektroniskā konfigurācija Aufbau principa izmantošana dažiem elementiem ir aplūkota tālāk:
Sēra elektronu konfigurācija
Atomu skaits sēra saturs ir 16, t.i., tajā ir 16 elektroni
Tagad, izmantojot Aufbau principu, sēra elektroniskā konfigurācija tiek uzrakstīta šādi:
[S] = 1 s 2 2s 2 2p 6 3s 2 3p 4
Slāpekļa elektronu konfigurācija
Slāpekļa atomu skaits ir 7, t.i., tajā ir 7 elektroni
Tagad, izmantojot Aufbau principu, slāpekļa elektroniskā konfigurācija ir uzrakstīta kā:
[N] = 1 s 2 2s 2 2p 3
Izņēmumi no būvniecības principa
Aufbau principam ir daži izņēmumi, proti, hroms un varš. To elektroniskā konfigurācija ir
urfi javed
Chromium elektroniskā konfigurācija
Chromium elektroniskajai konfigurācijai saskaņā ar Aufbau principu jābūt
- Cr(24): [Ar]3d 4 4s 2
Taču iepriekš minētā konfigurācija nav pareiza, jo faktiskā Chromium(Cr) elektroniskā konfigurācija ir,
- Cr(24): [Ar]3d 5 4s 1
Šīs elektroniskās konfigurācijas iemesls ir tas, ka puspildīta d-atomu orbitāle ir stabilāka nekā orbitāle, kas piepildīta saskaņā ar Aufbo principu.
Vara elektroniskā konfigurācija
Vara elektroniskajai konfigurācijai saskaņā ar Aufbau principu jābūt:
- Cu(29): [Ar]3d 9 4s 2
Iepriekš minētā konfigurācija nav pareiza, jo vara (Cu) faktiskā elektroniskā konfigurācija ir,
- Cu(29): [Ar]3d 10 4s 1
Šīs elektroniskās konfigurācijas iemesls ir tas, ka Pilnībā piepildīta d-atomu orbitāle ir stabilāka nekā orbitāle, kas piepildīta saskaņā ar Aufbo principu.
Lasīt vairāk
- Kvantu skaitļi
- Atomu orbitāļu forma
- Atomu struktūra
Struktūras princips – FAQ
Kas ir Aufbau princips ķīmijā?
Aufbau princips ķīmijā ir pamatprincips, ko izmanto, lai aizpildītu elektronus jebkura atoma atomu orbitālēs. Šī teorēma mums norāda secību, kādā elektroni ir piepildīti atoma orbitālē.
Kurš deva Aufbau principu?
Aufbau principu 1920. gadā sniedza slavenais dāņu fiziķis Nīls Bors.
Kāds ir Pauli izslēgšanas princips?
Pauli izslēgšanas princips nosaka, ka atomā nav divu elektronu ar visiem četriem kvantu skaitļiem t viņš pats. Vismaz viens no kvantu skaitļiem ir atšķirīgs visiem elektroniem atomā.
Kas ir n+l noteikums?
Noteikums n+l ir noteikums, kas nosaka, ka orbitāles enerģija ir atkarīga no galvenā kvantu skaitļa (n) un azimutālā kvantu skaitļa (l) summas. šo noteikumu sauc par (n+l) noteikumu.
Kādi ir Aufbau principa izņēmumi?
Aufbau principa izņēmums ir:
- Chromium Cr elektroniskā konfigurācija[24]
- Vara Cu elektroniskā konfigurācija[29]
