Atomu orbitāles , kas ir matemātiskas funkcijas, apraksta elektronu (vai elektronu pāru) viļņu uzvedību atomā. Atomu orbitālēm ir dažādas formas atkarībā no to veida. Atšķirīgās atomu orbitāļu formas raksturo to, ka pastāv vai nu lielākā, vai nulle varbūtība dažos virzienos atrast elektronu ap kodolu. Ir četru veidu orbitāles, katrai no tām ir atšķirīga forma un kuras apzīmē ar burtiem s, p, d un f. S un p orbitāles tiek ņemtas vērā, jo tās ir visizplatītākās ķīmiskajā un bioloģiskajā ķīmijā. An s-orbitāla centrā ir sfērisks kodols, a p-orbitāls ir hanteles formas, un četras no piecām d orbitāles ir āboliņa lapas formas. Piektā d orbitāle ir veidota kā gara hantele ar virtuli centrā. Atoma orbitāles ir sakārtotas slāņos vai elektronu apvalkos.
Kas ir atomu orbitāles?
Atomu orbitāles ir trīsdimensiju telpa atoma kodola tuvumā, kur ir maksimāla iespēja atklāt elektronu.
Saskaņā ar kvantu atomu modeli atomam var būt bezgalīgs skaits orbitāļu. Šīs orbitāles var klasificēt pēc to izmēra, formas vai orientācijas. Šaurāka orbitāle nozīmē, ka pastāv lielāka varbūtība noķert elektronu tuvu kodolam. Orbitālo viļņu funkciju bieži sauc par matemātisko funkciju, ko izmanto, lai izteiktu elektrona koordinātas. Elektrona atrašanās vietas noteikšanas iespējamību attēlo orbitālās viļņa funkcijas kvadrāts. Šī viļņa funkcija palīdz arī izveidot robežvirsmu diagrammas.
Orbitālā viļņa funkcija
The kvantu atomu modelis prognozē, ka atomam var būt ļoti daudz dažādu orbitāļu. Šīs orbitāles var grupēt pēc to izmēra, ģeometrijas vai slīpuma. Samazināts orbītas izmērs palielina varbūtību iegūt elektronu tuvu kodolam. Matemātisko funkciju, ko izmanto, lai attēlotu elektronu koordinātas, sauc par orbitālo viļņu funkcija . Elektrona atklāšanas iespējamību attēlo orbitālās viļņa funkcijas kvadrāts.
Mēs varam arī izmantot šo viļņu funkciju, lai izveidotu robežvirsmu diagrammas. Mēs varam labāk izprast orbitāļu formu, izmantojot dažādu orbitāļu pastāvīgās varbūtības blīvuma robežvirsmu diagrammas.
avl koki
Atomu orbitāļu formas
Atomu orbitāļu formas atšķiras. Tas nozīmē, ka elektronu varbūtības sadalījums, ko tie apraksta ap kodolu, ir atšķirīgs. Fakts, ka elektroni dažādās orbitālēs, visticamāk, atrodas dažādos apgabalos ap mātes kodolu un līdz ar to piedzīvo tā pievilcību ar dažādu spēku, ir viens no iemesliem, kāpēc orbitāļu enerģija ir dažāda. Ir pārsteidzoši, ka visām orbitālēm noteiktā ūdeņraža atoma apvalkā ir vienāda enerģija, bet tām ir dažādas formas. Tas ir saistīts ar dažādu ar enerģiju saistītu iemaksu novēršanu.
Bet, tiklīdz ir otrs elektrons, deģenerācija pazūd.
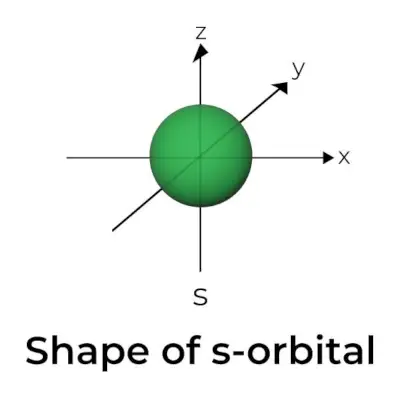
S-orbitāles forma
- S orbitālās robežvirsmas diagramma atgādina sfēru ar kodolu tās centrā, ko var attēlot divās dimensijās kā apli.
- s-orbitāles ir sfēriski simetriskas, kas nozīmē, ka varbūtība atrast elektronu noteiktā attālumā ir vienāda visos virzienos.
- Tāpat tiek parādīts, ka s orbitāles izmērs palielinās, palielinoties primārā kvantu skaitļa (n) vērtībai; tātad 4s> 3s> 2s> 1s.
- Mezgla punkts ir vieta, kur nav iespējas noteikt elektronu. Mezgli tiek iedalīti divos veidos: radiālie mezgli un leņķiskie mezgli. Attālumu no kodola aprēķina radiālie mezgli, savukārt orientāciju nosaka leņķiskie mezgli.
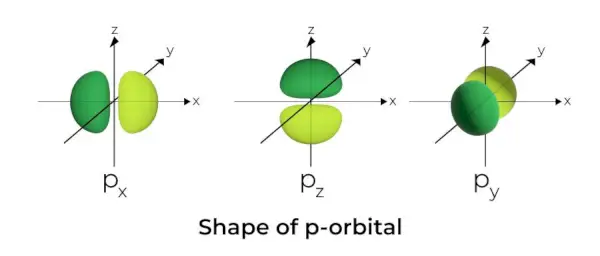
p-orbitāla forma
- P orbitāles veidojas kā hanteles.
- P orbitālais mezgls atrodas kodola centrā.
- Trīs orbitāļu klātbūtnes dēļ p orbitāle var aizņemt ne vairāk kā sešus elektronus.
- Katra p orbitāle sastāv no divām daļām, kas pazīstamas kā daivas, kas atrodas abās pusēs plaknei, kas iet pāri kodolam.
- Katrai p orbitālei ir daļas, kas pazīstamas kā daivas abās plaknes pusēs, kas iet pāri kodolam. Plaknē, kur krustojas abas daivas, elektrona atrašanas iespējamība ir nulle.
- Trīs orbitāles ir pazīstamas kā deģenerētas orbitāles, jo tām ir vienāds izmērs, forma un enerģija.
- Vienīgā atšķirība starp orbitālēm ir daivu orientācija. Tā kā daivas ir orientētas pa x, y vai z asi, tām tiek doti nosaukumi 2px, 2py, un 2pz. Mezglu skaita aprēķināšanai izmanto formulu n –2.
- Līdzīgi kā s orbitālēm, p orbitāļu izmērs un enerģija palielinās, palielinoties primārajam kvantu skaitlim (4p> 3p> 2p).
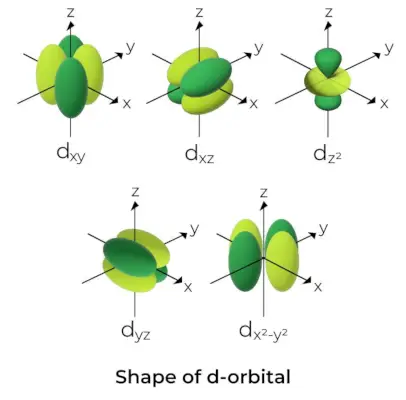
d-orbitāla forma
- D orbitālēm magnētiskās orbitālās kvantu skaitlis ir norādīts kā (-2,-1,0, 1,2). Rezultātā mēs varam apgalvot, ka ir piecas d-orbitāles.
- Šīs orbitāles ir apzīmētas ar simboliem dxy, dyz, dxz, dx2-un2, un dAr2.
- Pirmo četru d orbitāļu formas ir līdzīgas viena otrai, kas atšķiras no dAr2orbitāle, bet visu piecu d orbitāļu enerģija ir vienāda.
f-Orbitāla forma
- F orbitāles forma ir izkliedēta. Tā kā f orbitāles vērtība l=3, primārā kvantu skaitļa n minimālā vērtība ir 4.
- F orbitāles ekvivalentās ml vērtības ir (-3, –2, –1, 0, +1, +2, +3).
- Rezultātā l = 3 ir septiņas f orbitāles.

aizbēgt raksturs java
Deģenerētas orbitāles
Deģenerētas orbitāles ir tās, kurām ir tāda pati enerģija. Šīs orbitāles ir atšķirīgas (tās var būt atšķirīgi orientētas telpā ap atoma kodols ), tomēr tiem ir tāda pati enerģija. Ārējā lauka klātbūtnē p orbitāles deģenerācija netiek ietekmēta; tomēr f un d orbitāļu deģenerāciju var izjaukt, pieliekot sistēmai ārēju lauku (elektrisko vai magnētisko lauku).
Dažām orbitālēm būs lielāka enerģija, bet citām mazāka. Deģenerācija sistēmā vairs nepastāvēs. Piemēram, d orbitāles sastāv no piecām deģenerētām orbitālēm, kurām visām ir vienāda enerģija.
Lasīt vairāk:
- Molekulārās orbitālās teorijas
- Orbitāles piepildīšana atomā
- Hibridizācija
Bieži uzdotie jautājumi par atomu orbitāļu formām
1. jautājums: kā darbojas orbitāles?
Atbilde:
pārvērst virkni interger
Atomu orbitāle ir matemātiska izteiksme, kas atomu teorijā un kvantu mehānikā izsaka viena elektrona vai elektronu pāra viļņveidīgu uzvedību atomā. Katra orbitāle aizņems ne vairāk kā divus elektronus, katrs ar savu spina daudzumu.
2. jautājums: kas ir mezgla plakne?
Atbilde:
Plakni, kurā varbūtība atrast elektronu ir niecīga vai nulle, sauc par mezgla plakni.
3. jautājums: cik orbitāļu ir?
Atbilde:
Tā kā s apakšlīmenim ir tikai viena orbitāle, tajā var būt tikai divi elektroni. Tā kā p apakšlīmenī ir trīs orbitāles, var būt ne vairāk kā seši elektroni. Tā kā d apakšlīmenī ir 5 orbitāles, var būt ne vairāk kā 10 elektroni. Un katram no četriem apakšlīmeņiem ir septiņas orbitāles, kurās var būt ne vairāk kā 14 elektroni.
labākā hentai
4. jautājums. Kurām orbitālēm ir vislielākā enerģija?
Atbilde:
ievietošanas kārtošanas algoritms
Orbitālei 1 ir vislielākā enerģija. Elektrona enerģija ir enerģijas daudzums, kas nepieciešams, lai to izvadītu no atoma elektriskā burbuļa.
5. jautājums. Kāda ir atšķirība starp čaulu un orbitāli?
Atbilde:
Atomā apvalks ir vienas un tās pašas kvantu skaitļu teorijas n apakščaulu kopums. Katrā orbitālē ir divi elektroni, un elektroniem vienā orbitālē ir vienāda izmēra, leņķiskā impulsa lieluma un magnētiskā kvantu skaitļa definīcija.
6. jautājums. Kas ir sigma un pi saite?
Atbilde:
Atomu orbitāļu pārklāšanās rada sigma un pi saites. Sigma saites tiek izveidotas, pārklājoties atomu orbitālās daivas, savukārt Pi saites rodas, kad viena atomu orbitālā daiva pārklājas ar otru.
