NO hibridizācija 2 ir sp 2 . NO hibridizācijā tiek izveidotas trīs līdzvērtīgas hibrīda orbitāles2. Slāpekļa dioksīds jeb NO2sastāv no diviem skābekļa atomiem, kas apvienoti ar vienu slāpekļa atomu. NO hibridizācija2ir lietderīgi izpētīt atomu orbitāļu izvietojumu un tā ietekmi uz to molekulāro struktūru un īpašībām.
Šajā rakstā mēs izpētīsim hibridizācijas ideju un sniegsim skaidru un saprotamu NO hibridizācijas skaidrojumu2kopā ar abu tā jonu hibridizāciju NO2+un NĒ2–.
Satura rādītājs
- Slāpekļa dioksīds [NO2]
- Kas ir slāpekļa dioksīda (NO2) hibridizācija?
- NO2+ un NO2- hibridizācija
- NO2 hibridizācija: FAQ
Kas ir hibridizācija?
Hibridizācija ķīmijā ir atomu orbitāļu apvienošanas process, lai izveidotu jaunas hibrīda orbitāles, kas ietekmē savienojuma molekulāro ģeometriju un savienojuma īpašības.
Ir dažādi hibridizācijas veidi:
- sp Hibridizācija
- sp 2 Hibridizācija
- sp 3 Hibridizācija
Lasīt vairāk, Hibridizācija .
Kas ir slāpekļa dioksīda hibridizācija (NO2)?
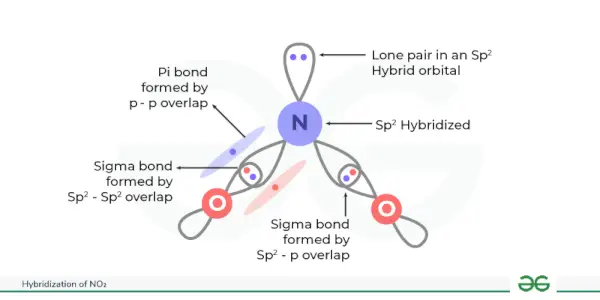
NO hibridizācija 2 ir sp 2 .
Šajā hibridizācijā tiek izveidotas trīs līdzvērtīgas hibrīda orbitāles. Šeit slāpeklis ir centrālais atoms, kas saistīts ar diviem skābekļa atomiem. Slāpeklī ir 5 valences elektroni, kas sakārtoti 2s22p. Tagad viens 2s orbitāles elektrons un divi elektroni 2p orbitālē piedalījās NO hibridizācijā2tādējādi kopumā veidojas trīs hibrīdorbitāles (1 + 2 = 3), kas dod sp2NO hibridizācija2.
Sigmas saites rodas, kad šīs hibrīdās orbitāles pārklājas ar skābekļa orbitālēm, un slāpekļa atoma p orbitāle veido pi saiti ar skābekļa atomu.
virkne java metodēs
Slāpekļa dioksīds [NO2]
Slāpekļa dioksīds rodas, apvienojot divus skābekļa atomus un vienu slāpekļa atomu un veido divatomu molekulu NO2. Tā ir sarkanbrūna gāze, kurai ir izteikts izskats un asa, kodīga smaka. Istabas temperatūrā tā ir gāze, kurai ir izliekta vai V-veida molekulārā ģeometrija.
Turklāt NĒ2ir svarīgs pētniecības temats ķīmiskajā un vides kontekstā, jo tas ietekmē gaisa piesārņojumu un atmosfēras ķīmiju.
Īpašības NO2
Svarīgās NO īpašības2ir uzskaitīti zemāk:
| Īpašums | Apraksts |
|---|---|
| Ķīmiskā formula | NĒ2 |
| Molekulārā struktūra | Liekts vai V-veida |
| Stāvoklis istabas temperatūrā | Gāze |
| Krāsa | Sarkanbrūns |
| Smarža Fredijs Merkūrijs | Ass, kodīgs |
| Kušanas punkts | −11,2 °C |
| Vārīšanās punkts | 21,2 °C |
Lūisa struktūra NO2
Sīks Lūisa struktūras apraksts NO2molekula ir dota zemāk:
- Slāpeklis veido dubultsaiti ar vienu skābekli un pieciem valences elektroniem, sadalot divus elektronus starp diviem elementiem.
- Viens elektrons tiek pievienots otrajam skābeklim, jo tas veido vienotu saiti.
- Slāpekļa atoms saglabā vienu vientuļo pāri.
- Ar slāpekli kā centrālo atomu un negatīvu lādiņu (NO2–) visā molekulā, šī konfigurācija rada lineāru struktūru.

Lasīt vairāk,
- Slāpekļa dioksīds
- Slāpekļa oksīdi
Saites leņķis un ģeometrija NO hibridizācijā2
NO molekulārā ģeometrija2hibridizācijas rezultātā kļūst saliekta vai V-veida. Slāpekļa atoms iziet sp2hibridizācija, kas rada šo konfigurāciju. Slāpekļa un skābekļa atomi veido saiknes leņķi, kas ir aptuveni 134 grādi . Hibrīdu orbitāļu izvietojums rada šo deformēto saites leņķi, kas palielina slāpekļa dioksīdu (NO2) atšķirīga struktūra un īpašības.
NO hibridizācija2+un NĒ2–
Hibridizācija ir NO2+un NĒ2–apspriests zemāk:
Slāpekļa jonu hibridizācija[NO2+]
NO hibridizācija2+ir šāds:
- Slāpekļa jonā ir pozitīvs lādiņš (NO2+).
- In NO2+, divi skābekļa atomi un viens slāpekļa atoms ir saistīti kopā.
- Lai izveidotu divas sp hibrīda orbitāles, slāpekļa atoms iziet sp hibridizāciju.
- Lai izveidotu divas sigma saites, šīs sp hibrīda orbitāles pārklājas ar skābekļa p orbitālēm.
- Molekulas ģeometrija ir lineāra.
- Tālāk ir parādīts hibridizācijas attēlojums: N(sp) + O(p) + O(p).
Jonu nitrāta hibridizācija [NO2–]
NO hibridizācija2–ir šāds:
- Nitrītu jonos ir negatīvs lādiņš (NO2–).
- In NO2–, divi skābekļa atomi un viens slāpekļa atoms ir saistīti kopā.
- Lai izveidotu trīs sp2hibrīda orbitāles, slāpekļa atoms iet caur sp2hibridizācija.
- Lai izveidotu trīs sigma saites, šīs sp2hibrīda orbitāles pārklājas ar skābekļa p orbitālēm.
- Molekulas ģeometrija ir plakana trigonāli.
- Sekojošais attēlo hibridizāciju: N (sp2) + O(p) + O(p).
Secinājums
Noslēgumā, uzzinot vairāk par NO2Hibridizācija piedāvā svarīgas jaunas perspektīvas par molekulas uzbūvi un īpašībām. Kopējo ģeometriju ietekmē slāpekļa sp2hibridizācija, kas dod saliektu vai V-veida molekulu ar saites leņķi aptuveni 134 grādi. NO unikālās īpašības2daļēji ir saistīti ar nevienlīdzīgajiem saišu garumiem N-O saitēs.
kā java izsaukt metodi
| Aspekts | Apraksts |
|---|---|
| Hibridizācija | NĒ2iziet sp2hibridizācija |
| Molekulārā ģeometrija | Liekts vai V-veida |
| Saites leņķis | Aptuveni 134 grādi starp slāpekli un skābekli |
| Saites garuma kropļojumi | Nevienlīdzīgi saišu garumi sp2hibridizācija |
Pārbaudiet arī, SF hibridizācija 4
NO hibridizācija2: FAQ
1. Kā NĒ2Ietekmē vidi?
Viens no galvenajiem gaisa piesārņotājiem ir NĒ2, kas ietekmē gan ekosistēmu, gan cilvēku veselību, izraisot elpošanas problēmas un skābos lietus.
2. Kurš saites leņķis ir lielāks starp NO2+vai nē2?
Tā kā NĒ2ir mazāks saites leņķis ar sp2 hibridizāciju un trigonālu plakanu struktūru, NO2+ ir plašāks saites leņķis, jo tas iet caur sp hibridizāciju ar lineāro ģeometriju.
js onclick
3. Kāda ir NO ģeometrija2?
NĒ struktūra2molekula ir saliekta vai V-veida.
4. Kāda ir NO molekulārā ģeometrija2+?
NO ģeometrija2+molekulas ir lineāras.
5. Cik sigma un pi saišu ir NO₂?
NO₂ ir viena sigma saite un viena pi saite.
6. Vai NO₂ ir polārs vai nepolārs?
NO₂ ir polāra daļiņa, jo uz slāpekļa atrodas vientuļš pāris un izliekts subatomu aprēķins, kas izraisa nelīdzenu lādiņa cirkulāciju.
7. Kāds ir saites leņķis NO₂?
Saites leņķis NO2ir aptuveni 134 grādi.
