Jēdziens par hibridizācija ir definēts kā divu atomu orbitāļu apvienošanas process, lai izveidotu jauna veida hibridizētas orbitāles. Šīs sajaukšanās rezultātā parasti veidojas hibrīda orbitāles ar pilnīgi atšķirīgu enerģiju, formu utt. Hibridizāciju galvenokārt veic viena un tā paša enerģijas līmeņa atomu orbitāles. Tomēr šajā procesā var piedalīties gan pilnībā piepildītas, gan daļēji piepildītas orbitāles, ja to enerģija ir vienāda. Hibridizācijas jēdziens ir valences saišu teorijas paplašinājums, kas palīdz mums izprast saišu veidošanos, saišu enerģiju un saišu garumus.
Kas ir hibridizācija?
Kad divas atomu orbitāles apvienojas, veidojot hibrīdu orbitāli molekulā, atsevišķu atomu orbitāļu enerģija tiek pārdalīta, lai iegūtu līdzvērtīgas enerģijas orbitāles. To sauc par hibridizāciju.
Salīdzināmu enerģiju atomu orbitāles tiek sajauktas hibridizācijas procesā, kas galvenokārt ietver divu orbitāļu vai divu 'p' orbitāļu sapludināšanu vai 's' orbitāles sajaukšanu ar 'p' orbitāli, kā arī 's' orbitāle ar 'd' orbitāli.
Hibrīdās orbitāles ir jaunās orbitāles, kas veidojas šī procesa rezultātā. Vēl svarīgāk ir tas, ka hibrīdās orbitāles var izmantot, lai izskaidrotu atomu saites īpašības un molekulāro ģeometriju. Piemēram, ogleklis veido četras atsevišķas saites, kurās valences apvalka orbitāle apvienojas ar trim valences apvalka p orbitālēm. Šī kombinācija ģenerē četras ekvivalentas sp3maisījumi. Tie tiks sakārtoti tetraedriskā veidā ap oglekli, kas ir saistīts ar četriem dažādiem atomiem.
Hibridizācijas veida noteikšanas soļi
Lai saprastu atoma vai jonu hibridizācijas veidu, ir jāievēro šādi noteikumi.
- Pirmkārt, nosakiet kopējo valences elektronu skaitu, kas atrodas atomā vai jonos.
- Pēc tam saskaitiet vientuļo pāru skaitu, kas pievienoti šim atomam vai jonam.
- Tagad nepieciešamo orbitāļu skaitu var aprēķināt, saskaitot dupleksa vai okteta skaitu un vientuļo elektronu pāru skaitu.
- Jāņem vērā, ka orbitāļu ģeometrija atomos vai jonos ir atšķirīga, ja nav vientuļo elektronu pāra.
Hibridizācijas iezīmes
- Hibridizācija notiek starp atomu orbitālēm ar vienādu enerģiju.
- Izveidoto hibrīdu orbitāļu skaits ir vienāds ar sajaucamo atomu orbitāļu skaitu.
- Hibridizācijā nav jāpiedalās visām daļēji piepildītajām orbitālēm. Var piedalīties pat orbitāles, kas ir pilnībā piepildītas, bet kurām ir nedaudz atšķirīga enerģija.
- Hibridizācija notiek tikai saites veidošanās laikā, nevis vienā gāzveida atomā.
- Ja ir zināma molekulas hibridizācija, var paredzēt molekulas formu.
- Hibrīda orbitāles lielākā daiva vienmēr ir pozitīva, savukārt mazākā daiva pretējā pusē vienmēr ir negatīva.
Veidi no hibridizācijas
Hibridizāciju var klasificēt kā sp3, sp2, sp., sp3d, sp3d2, vai sp3d3pamatojoties uz sajaukšanā iesaistīto orbitāļu veidiem.
alfabēts uz cipariem
sp Hibridizācija
Tas notiek, kad viena s un viena p orbitāle atoma galvenajā apvalkā apvienojas, veidojot divas jaunas līdzvērtīgas orbitāles. Jaunizveidotās orbitāles ir pazīstamas kā sp hibridizētās orbitāles. Tas rada lineāras molekulas 180° leņķī. Tas ietver vienas orbitāles un vienas vienādas enerģijas “p” orbitāles apvienošanu, lai izveidotu jaunu hibrīdu orbitāli, kas pazīstama kā sp hibridizētā orbitāle.
- To sauc arī par diagonālo hibridizāciju.
- Katra sp hibridizētā orbitāle satur vienādu skaitu s un p rakstzīmju.
- Visi berilija savienojumi, piemēram, BeF2, Nu2un BeCl2, ir piemēri.

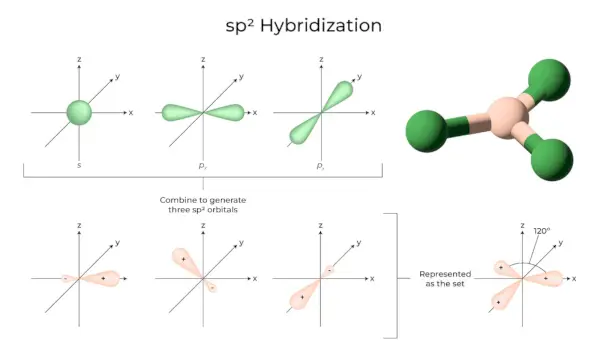
sp2Hibridizācija
Tas notiek, kad viena atoma apvalka viena s un divas p orbitāles apvienojas, veidojot trīs līdzvērtīgas orbitāles. Jaunizveidotās orbitāles ir pazīstamas kā sp2hibrīda orbitāles. To sauc arī par trigonālo hibridizāciju. Tas nozīmē vienas orbitāles apvienošanu ar divām vienādas enerģijas “p” orbitālēm, lai izveidotu jaunu hibrīda orbitāli, kas pazīstama kā sp2. Trigonālās simetrijas s un p orbitāļu maisījums tiek turēts 120 grādos. Visas trīs hibrīdas orbitāles paliek vienā plaknē un veido 120° leņķi viena ar otru.
- Katrai izveidotajai hibrīdai orbitālei ir 33,33% un 66,66% 'p' raksturs.
- Molekulām ar trīsstūrveida plakanu formu ir centrālais atoms, kas ir saistīts ar trim citiem atomiem un ir sp2hibridizēts. Piemēri ir bora savienojumi.
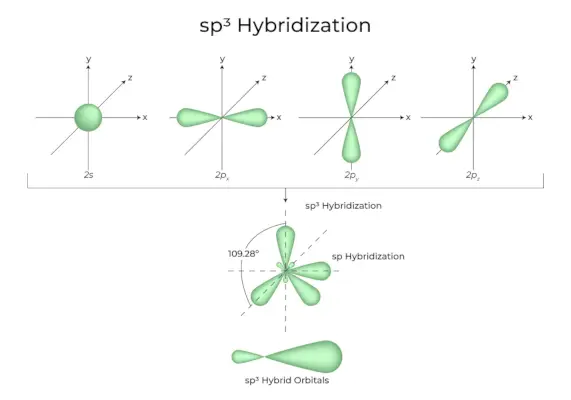
sp3Hibridizācija
Kad viena “s” orbitāle un trīs “p” orbitāles no viena atoma apvalka apvienojas, veidojot četras jaunas līdzvērtīgas orbitāles, hibridizāciju sauc par tetraedrisko hibridizāciju vai sp3. Jaunizveidotās orbitāles ir pazīstamas kā sp3hibrīda orbitāles. Tie ir vērsti uz regulāra tetraedra četriem stūriem un veido 109 ° 28′ leņķi viens ar otru.
- Sp3hibrīda orbitāles veido 109,28 grādu leņķi.
- Katrai hibrīdai orbitālei ir 25% s raksturs un 75% p rakstzīme.
- Etāns un metāns ir divi piemēri.
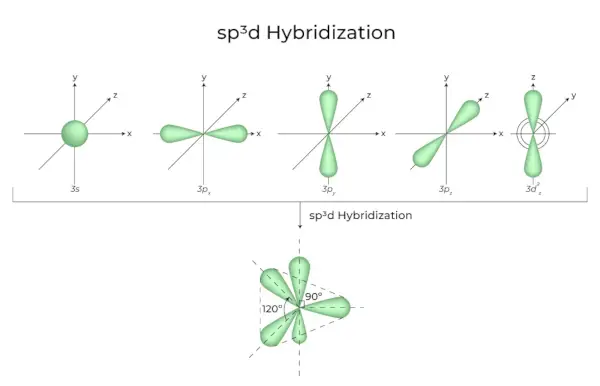
sp3d Hibridizācija
1s orbitāļu, 3p orbitāļu un 1d orbitāļu sajaukšana rada 5 sp3d hibridizētas orbitāles ar vienādu enerģiju. To ģeometrija ir trigonāla bipiramidāla. S, p un d orbitāļu kombinācija rada trigonālo bipiramidālo simetriju. Ekvatoriālās orbitāles ir trīs hibrīdas orbitāles, kas ir orientētas 120° leņķī viena pret otru un atrodas horizontālā plaknē.
- Atlikušās divas orbitāles, kas pazīstamas kā aksiālās orbitāles, atrodas vertikālajā plaknē ekvatoriālo orbitāļu 90 grādu plaknē.
- Hibridizācija, piemēram, fosfora pentahlorīdā (PCl5).
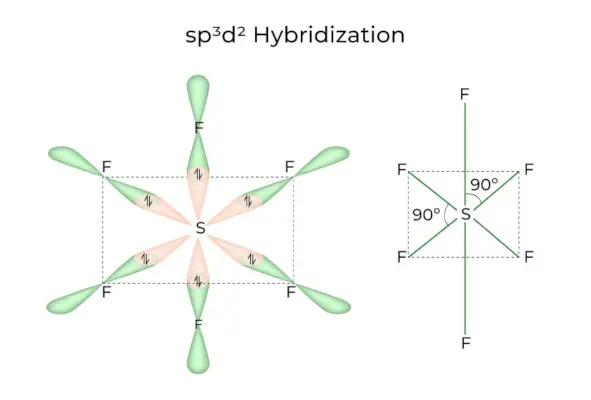
sp3d2 Hibridizācija
Kad 1s, 3p un 2d orbitāles apvienojas, veidojot 6 identiskas sp3d2hibrīda orbitāles, hibridizāciju sauc par sp3d2Hibridizācija. Šīs septiņas orbitāles norāda uz oktaedra stūriem. Tie ir slīpi viens pret otru 90 grādu leņķī.
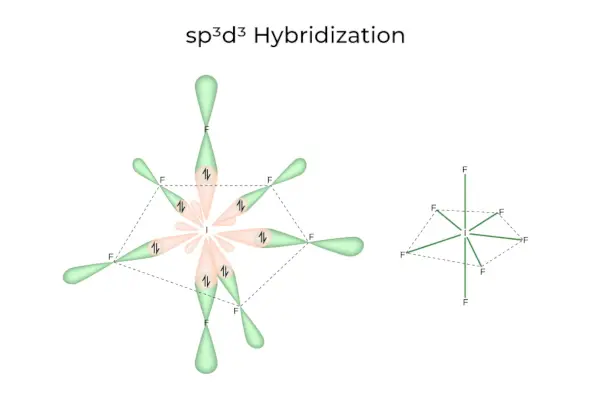
sp3d3Hibridizācija
Tam ir 1s, 3p un 3d orbitāles, kas apvienojas, veidojot 7 identiskas sp3d3hibrīda orbitāles. Šīs septiņas orbitāles norāda uz piecstūra bipiramīdas stūriem. piem. JA6.
Hibridizācijas formas
- Lineāra: sp hibridizāciju izraisa divu elektronu grupu mijiedarbība; orbītas leņķis ir 180°. Trigonāls plakans: ir iesaistītas trīs elektronu grupas, kā rezultātā rodas sp2hibridizācija; orbitāles atrodas 120° attālumā viena no otras. Tetraedris: ir iesaistītas četras elektronu grupas, kā rezultātā veidojas sp3hibridizācija; orbītas leņķis ir 109,5°. Trigonāls bipiramidāls: ir iesaistītas piecas elektronu grupas, kā rezultātā veidojas sp3d hibridizācija; orbītas leņķi ir 90° un 120°. Oktaedris: ir iesaistītas sešas elektronu grupas, kā rezultātā veidojas sp3d2hibridizācija; orbitāles ir 90° viena no otras.
FAQ ieslēgts Hibridizācija
1. jautājums. Kura hibrīda orbitāle starp sp, sp2 un sp3 ir elektronnegatīvāka?
Atbilde:
S rakstzīmes procentuālais daudzums sp, sp2, un sp3hibridizētais ogleklis ir attiecīgi 50%, 33,33% un 25%. S orbitāles sfēriskās formas dēļ kodols to vienmērīgi pievelk no visiem virzieniem. Rezultātā s-zīmju hibrīda orbitāle būs tuvāk kodolam un līdz ar to elektronnegatīvāka. Rezultātā sp hibridizētais ogleklis ir elektronnegatīvākais.
2. jautājums: kas ir hibrīda orbitāles?
Atbilde:
virkņu masīvs
Hibrīdās orbitāles veidojas, apvienojot standarta atomu orbitāles, kā rezultātā veidojas jaunas atomu orbitāles.
3. jautājums: kādas ir piecas hibridizācijas formas?
Atbilde:
Lineāra, trigonāla plakana, tetraedriska, trigonāla bipiramidāla un oktaedriska ir piecas hibridizācijas pamatformas.
jauna rinda python
4. jautājums: Kāpēc amīda molekula izskatās kā sp3hibridizēts, bet ir sp2?
Atbilde:
Ja atomu ieskauj divas vai vairākas p orbitāles, vai arī tam ir vientuļš pāris, kas spēj ielēkt p orbitālē, vispārējais hibridizācijas process mainīsies. Rezultātā amīda molekulas gadījumā vientuļais pāris nonāk p orbitālē, kā rezultātā veidojas trīs blakus paralēlas p orbitāles.
5. jautājums: kāds ir Benta noteikums?
Atbilde:
Centrālais atoms, kas savienots ar daudzām molekulas grupām, hibridizēsies, izraisot orbitāļu ar lielāku s raksturu virzību uz elektropozitīvām grupām un orbitāļu ar lielāku p raksturu novirzīšanu uz elektronegatīvām grupām.
