Bāze ir ķīmisks savienojums, kas sastāv no OH–jonus un pieņem protonus. Bāze ķīmijā ir tie savienojumi, kas kļūst sarkani lakmusa zilā krāsā un, reaģējot ar skābi, neitralizē reakciju, veidojot sāli un ūdeni. Bāzes pH vērtība ir lielāka par 7. Bāzes ir rūgtas pēc garšas un slidenas. Bāzes, kas šķīst ūdenī, sauc par sārmiem. Bāzes piemēri ir metālu oksīdi, metālu hidroksīdi utt. Ziepes ir tādas bāzes piemērs, ko mēs izmantojam ikdienas dzīvē. Šajā rakstā mēs detalizēti uzzināsim par bāzu definīciju, īpašībām un ķīmiskajām reakcijām.

Bāzes definīcija
Bāze ir definēta kā ķīmisks savienojums, kura pH vērtība ir lielāka par 7, pieņem protonu, neitralizē skābi un pārvērš sarkano lakmusu zilā krāsā. Tie parasti atbrīvo OH–jonu uz disociāciju. Piemēri ir NaOH, NaHCO3,utt. Tālāk ir norādītas dažas vispārīgas funkcijas, ko parāda bāze:
- Viņiem ir rūgta garša
- Tie ir slideni pieskaroties
- Tie kļūst sarkani lakmusa zili
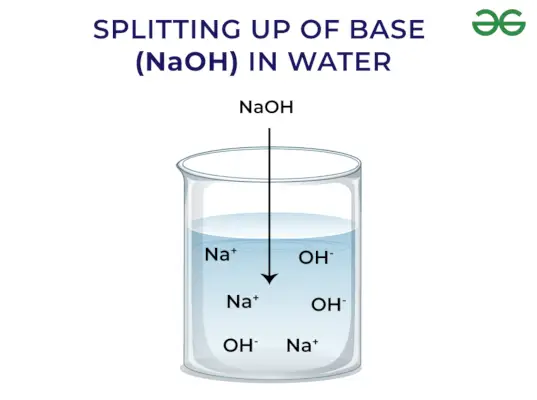
- Viņi atbrīvo OH–jonu, izšķīdinot ūdenī
- Tie vada elektrību šķīduma formā
Bāzes ir viens no svarīgākajiem ķīmiskajiem savienojumiem, ko izmanto ikdienas dzīvē. Bāzes tiek izmantotas kā antacīds, lai kontrolētu skābumu, un zobu pastā, lai neitralizētu baktēriju darbību, kas rada skābi mūsu mutē un novērš emaljas un dobuma degradāciju. Tos izmanto arī kā cepamo pulveri, cepamo sodu un veļas pulveri.
Lūisa bāze
Lūisa bāzes ir savienojumi, kuriem ir elektronu pāris, un tie var tos nodot savienojumiem, kuriem trūkst elektronu pāru. Lūisa bāzes pēc būtības ir nukleofīlas, t.i., tās mīl kodolus, kas nozīmē, ka tās ar saviem elektronu pāriem uzbruks pozitīvi lādētam centram. Lūisa bāzes piemēri ietver amonjaku, jo amonjakā (NH3) centrālais atoms slāpeklī ir 5 elektroni, no kuriem 3 tiek izmantoti saišu veidošanai ar 3 ūdeņraža atomiem un viens elektronu pāris paliek pie N atoma, tādējādi veidojot NH3Lūisa bāze.
ipconfig priekš ubuntu
Arrēnija bāze
Saskaņā ar Arrhenius koncepciju bāzes ir savienojumi, kas izšķīdinot ūdenī atbrīvo hidroksīda jonus un palielina hidroksiljonu koncentrāciju ūdens šķīdumā. Piemēram, kad KOH tiek izšķīdināts ūdenī, tas dos OH–jonu un tādējādi palielināt OH koncentrāciju–ūdenī.
Bronsteda bāze
Bronsteda bāzes koncepcija ir Arrēnija koncepcijas uzlabota versija, kurā teikts, ka bāzes ir savienojumi, kas pieņem H.+jonu vai protonu, lai veidotu to konjugētu skābi. Piemēram, Cl–ir bāze, kas pieņem H+veidot HCl kā konjugētu skābi.
Bāžu veidi
Bāzes var klasificēt pēc skābuma, koncentrācijas un jonizācijas spējas. Klasifikācija ir minēta zemāk
Bāžu veidi, pamatojoties uz skābumu
Bāzes skābums attiecas uz aizvietojamo hidroksilgrupu skaitu, kas atrodas vienā bāzes molekulā. Pamatojoties uz skābumu, bāzes iedala trīs kategorijās:
- Monoskābā bāze
- Diskābā bāze
- Triacīda bāze
Monoskābs: Monoskābās bāzes ir tās, kas satur tikai vienu nomaināmu hidroksiljonu un mijiedarbojas tikai ar vienu ūdeņraža jonu. Monoskābās bāzes ietver NaOH, KOH un citas.
Diacīds: Diskābā bāze ir bāze ar diviem nomaināmiem hidroksiljoniem, kas mijiedarbojas ar diviem ūdeņraža joniem. Ca(OH)2, Mg(OH)2, un citas divskābes bāzes ir piemēri.
Triacīds: Triskābā bāze ir bāzes veids, kas satur trīs nomaināmus hidroksiljonus un trīs ūdeņraža jonus. Triskābās bāzes ietver Al(OH)3, Fe(OH)3, un citi.
Bāžu veidi, pamatojoties uz to koncentrāciju ūdens šķīdumā
Koncentrācija attiecas uz bāzes daudzumu ūdens šķīdumā. Pamatojoties uz to koncentrāciju ūdens šķīdumā, bāzes iedala divās kategorijās:
- Koncentrēta bāze
- Atšķaidīta bāze
Koncentrēta bāze: Koncentrētas bāzes ir tās, kurās bāzes daudzums ir liels salīdzinājumā ar šķīdinātāju. Piemēram, koncentrēts NaOH šķīdums.
Atšķaidīta bāze: Šāda veida bāzēm ūdens šķīdumā ir zemāka bāzes koncentrācija. Atšķaidīšana ir process, kurā samazina izšķīdušās vielas procentuālo daudzumu, pievienojot vairāk šķīdinātāja. Piemēram, atšķaidiet NaOH, atšķaidiet KOH un tā tālāk.
Bāžu veidi, pamatojoties uz jonizācijas pakāpi
Jonizācijas pakāpe attiecas uz ķīmiska savienojuma spēju atbrīvot to sastāvā esošo jonu, kad tas ir izšķīdināts ūdenī. Bāzes gadījumā jonizācijas pakāpe attiecas uz bāzes spēju atbrīvot OH–jonus, kad tie ir izšķīdināti ūdenī. Pamatojoties uz jonizācijas pakāpi, bāzes iedala divos veidos:
- Spēcīga bāze
- Vāja bāze
Spēcīga bāze: Spēcīgas bāzes ir tās bāzes, kas pilnībā sadalās un, izšķīdinot ūdenī, atbrīvo OH-jonu. Daži stipru bāzu piemēri ir NaOH, KOH utt.
Vāja bāze: Bāzes, kas pilnībā nedisociējas un atbrīvo tikai daļu OH-jona, sauc par vājo bāzi. Vāju bāzu piemēri ir Al (OH)3,Cu(OH)2,utt.
Uzzināt vairāk, Spēcīgas un vājas bāzes
Bāžu īpašības
Kā zināms, bāzes ir ķīmiski savienojumi, kuriem ir OH-jons, tie kļūst sarkani lakmuszilā krāsā utt. Šajā sadaļā mēs uzzināsim par bāzu fizikālajām un ķīmiskajām īpašībām, kā arī īsu informāciju par to vispārīgajām īpašībām.
Pamatnes vispārīgās īpašības
Bāzes vispārīgās īpašības ir minētas zemāk:
- Hidroksīda jons (OH–) ūdenī izdalās bāzes. Jo spēcīgāka kļūst bāze, jo tiek atbrīvots vairāk jonu.
- Bāzes reaģē ar skābi, veidojot sāli Skābes reaģē ar bāzēm. Šo bāzes reakciju ar skābi sauc par neitralizācijas reakciju.
- Pamatnes sarkano lakmusu pārvērš zilā krāsā.
- Proteīna struktūru var mainīt bāzes. Bāzēm ir šī kvalitāte, kas liek tām justies gludām. Ziepes ir pamatne, kas mitrā stāvoklī kļūst neticami slidena uz ādas. Dažas spēcīgas bāzes ir ārkārtīgi bīstamas, jo tās spēj mainīt olbaltumvielu struktūru.
Bāžu fiziskās īpašības
Bāzes garša rūgta: Bāzes pēc garšas ir rūgtas. Tā rūgtuma dēļ mums ir tikai daži sārmaini ēdieni. Ir tikai daži sārmaini pārtikas materiāli. Bāzes ir jāgaršo ar lielāku piesardzību, salīdzinot ar skābēm.
Pamatnes saskarē ir slidenas: Pieskaroties, pamatnes ir slidenas. Piemēram, ziepes.
Bāzes atbrīvo OH – Jons: Kad bāzes izšķīdina ūdenī, tās atbrīvo hidroksiljonu (OH–). Atkarībā no spējas atbrīvot hidroksiljonus tos klasificē kā stiprus un vājus.
Bāzes neitralizē skābes: Kad bāzes reaģē ar skābēm, tās viena otru neitralizē un rada sāli un ūdeni. Šo reakciju sauc Neitralizācijas reakcija . Pieņemsim, ka mums ir skābe HY un bāze “XOH”, tad izveidotā sāls būs “XY”. Šīs reakcijas vienādojumu var dot kā HY + XOH → HOH + XY.
Bāzes denaturēts proteīns: Olbaltumvielu denaturēšana nozīmē proteīna stabilitātes un struktūras iznīcināšanu. Tādējādi tiek izmantota cilvēkiem kaitīga bāze, jo cilvēka āda un mati sastāv no olbaltumvielām, un, ja tiek izmantoti spēcīgi sārmi, piemēram, nātrija vai kālija hidroksīds, ko sauc arī par sārmu, tie kaitīgi ietekmē cilvēka ādu.
Pamatnes sarkano lakmusu pārvērš zilā: Kad pamatnes nonāk saskarē ar sarkano lakmusu, tās kļūst zilas. Taču jāņem vērā, ka šādas izmaiņas nav novērojamas, mēģinot reaģēt sausu pamatni ar sarkanu lakmusa papīru. Lakmusa papīra tests ir viena no vecākajām bāzes pārbaudes metodēm. Tomēr pastāv arī citi rādītāji, piemēram, fenolftaleīns
Bāzes vada elektrību: Kad bāzes ir šķīduma formā, tām ir kustīgs OH-jons, tāpēc tās var vadīt elektrību.
hashmap
Bāžu ķīmiskās īpašības
- Bāzes reakcija ar metāliem: Kad sārms (bāze) reaģē ar metālu, rodas sāls un ūdeņraža gāze.
Sārms + metāls → Sāls + ūdeņradis
Piemēri:
- Kad nātrija hidroksīds mijiedarbojas ar alumīnija metālu, rodas nātrija alumināts un ūdeņraža gāze.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Kad nātrija hidroksīds mijiedarbojas ar metālu cinku, tas rada ūdeņraža gāzi un nātrija cinkātu.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Nemetālu oksīdu reakcija ar bāzi: Sāls un ūdens veidojas, nemetāliskiem oksīdiem reaģējot ar bāzi.
Nemetāla oksīds + Bāze → Sāls + Ūdens
Kad kalcija hidroksīds, bāze reaģē ar oglekļa dioksīdu, tad rodas kalcija karbonāts un ūdens.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Sārmu/bāzes reakcija ar amonija sāļiem: Amonjaks rodas, sārmiem reaģējot ar amonija sāļiem.
Sārms + amonija sāls → Sāls + ūdens + amonjaks
Kalcija hidroksīdam reaģējot ar amonija hlorīdu, veidojas kalcija hlorīda ūdens un amonjaks.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Bāžu piemēri
Bāzes parasti ir metāla oksīds, metāla hidroksīds, metāla ūdeņraža karbonāts, metāla karbonāti utt. Apskatīsim dažus bāzu piemērus un to pielietojumu tabulas veidā:
| Bāzes | Lietojumprogrammas |
|---|---|
| Kālija hidroksīds KOH | Izmanto sārma baterijās |
| Nātrija hidroksīds NaOH | Izmanto ziepju un mazgāšanas līdzekļu ražošanā |
| Magnija hidroksīds Mg(OH) 2 | Lieto kā antacīdus |
| Nātrija bikarbonāts NaHCO 3 atribūta kļūda python | Izmanto kā cepamo sodu |
| Nātrija karbonāts Jau tagad 2 CO 3 | Izmantota kā veļas soda |
| Amonjaks NH 3 | Izmanto tīrīšanas un farmācijas produktu ražošanā |
| Kalcija hidroksīds Ca(OH) 2 | Lietots White Washing |
Bāžu izmantošana
Ir dažādi bāzes izmantošanas gadījumi, daži no tiem ir:
- Nātrija hidroksīdu izmanto ziepju un papīra ražošanā. Nātrija hidroksīdu (NaOH) izmanto arī viskozes ražošanā.
- Balināšanas pulveris ir izgatavots no Ca (OH)2, ko parasti sauc par dzēstiem kaļķiem vai kalcija hidroksīdu.
- Kalcija hidroksīdu izmanto, lai izveidotu sausos maisījumus krāsošanai un dekorēšanai.
- Magnija hidroksīds, tautā pazīstams kā magnēzija piens, ir caurejas līdzeklis, ko plaši izmanto. To lieto arī kā antacīdu, jo tas samazina lieko skābumu cilvēka kuņģī.
- Laboratorijās amonija hidroksīds ir kritisks reaģents.
- Dzēstos kaļķus var izmantot, lai neitralizētu jebkādu lieko skābumu augsnēs.
Lasīt vairāk
- Skābe, bāze un sāls
- Skābes stiprums
- Skābes un bāzes jonizācija
Bieži uzdotie jautājumi par bāzēm ķīmijā
1. Kas ir bāzes?
- Bāzes savienojumiem ir rūgta garša.
- Lielākajai daļai bāzu tekstūra ir ziepjveida.
- Pārbaudot uz lakmusa papīra, tas vairumā gadījumu pārvērš sarkano lakmusa papīru zilā lakmusa papīrā.
- Šķīdumā bāzes savienojumi arī vada elektrību.
- Bāzes savienojumus izšķīdinot ūdenī, tiek atbrīvoti OH-joni.
2. Kādas ir bāzu funkcijas?
Mājās mēs izmantojam bāzes kā tīrīšanas līdzekļus un antacīdus. Ziepes, sārms (ko izmanto cepeškrāsns tīrīšanas līdzekļos), magnēzija piens un Tums ir populāru mājās gatavotu pamatņu piemēri. Katram no tiem pH ir lielāks par septiņiem, tas var patērēt brīvu ūdeņradi un neitralizēt skābes.
3. Kāda ir vissvarīgākā atšķirība starp skābi un bāzi?
Skābes un bāzes ir divu veidu kodīgas ķīmiskas vielas. Skābajiem materiāliem ir pH vērtība no 0 līdz 7, savukārt bāzēm pH vērtība ir no 7 līdz 14. Skābes ir jonu ķīmiskas vielas, kas sadalās ūdenī, veidojot ūdeņraža jonu (H+), bet bāze disociējas, veidojot OH-jonu.
4. Kādas ir bāzu fiziskās īpašības?
- Viņiem ir rūgta garša.
- Viņu ūdens šķīdumiem ir ziepjveida kvalitāte.
- Tie maina lakmusa papīra krāsu no sarkanas uz zilu.
- To ūdens šķīdumi ir elektriski vadoši.
- Izdaloties ūdeņraža gāzei, bāzes reaģē ar metāliem, veidojot sāli.
5. Kas notiks, kad kalcija hidroksīds reaģēs ar amonija hlorīdu?
Kalcija hidroksīdam reaģējot ar amonija hlorīdu, veidojas kalcija hlorīda ūdens un amonjaks.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Kas notiks, kad nātrija hidroksīds reaģēs ar metālu cinku?
Kad nātrija hidroksīds mijiedarbojas ar metālu cinku, tas rada ūdeņraža gāzi un nātrija cinkātu.
nejauši c2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Kas ir Lūisa bāze?
Lūisa bāze ir savienojumi, kas nodod elektronu pāri savienojumam, kuram trūkst elektronu. Piemērā ietilpst NH3.
8. No kā ir izgatavotas pamatnes?
Bāzes parasti sastāv no OH–jonu. Bez šiem metālu oksīdiem bāzes ir arī karbonāti un ūdeņraža karbonāti.
9. Kas ir sārmi?
Bāzes, kas šķīst ūdenī, sauc par sārmiem. Piemērs ir nātrija hidroksīds NaOH.
10. Kas ir stipra bāze un vāja bāze?
Bāzes, kas pilnībā sadalās, veidojot OH–jonus, kas izšķīst ūdenī, sauc par stipru bāzi. Piemēri ietver NaOH. Vājas bāzes ir tās, kas pilnībā neizdalās, lai atbrīvotu OH–jonu sauc par vāju bāzi. Vāju bāzu piemēri ir amonija hidroksīds.
