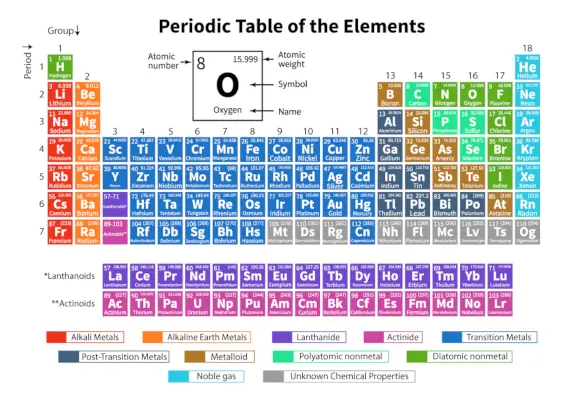
The Periodiskā tabula elementu ir sistemātisks 118 zināmu ķīmisko elementu izkārtojums. Šie ķīmiskie elementi ir sakārtoti pieaugošā atomu skaita secībā. Horizontālās rindas no kreisās uz labo pusi sauc par periodiem, savukārt vertikālās kolonnas no augšas uz leju sauc par grupām periodiskajā tabulā.
Satura rādītājs
- Kas ir periodiskā tabula?
- Periodiskās tabulas elementu saraksts
- Svarīgi termini periodiskajā tabulā
- Elementu klasifikācija periodiskajā tabulā
- Mendeļejeva periodiskā tabula
- Bieži uzdotie jautājumi par elementu periodisko tabulu
Kas ir periodiskā tabula?
Periodiskā tabula ir tabulas attēlojums, kurā visi zināmie ķīmiskie elementi ir sakārtoti horizontālās rindās, ko sauc par periodiem, un vertikālās kolonnas, ko sauc par grupām, pamatojoties uz to. atomskaitlis un atomu struktūra attiecīgi.
Tas ir visu zināmo elementu izkārtojums un tāpēc sniedz informāciju par elementiem, piemēram, to masu, elektronu skaitu, elektronu konfigurāciju un to unikālajām ķīmiskajām īpašībām.
Periodiskās tabulas elementu saraksts
Šeit ir tabula, kurā attēloti 118 periodiskās tabulas elementi. Uzskaitītie elementi ir sakārtoti atbilstoši pieaugošajai atomu skaita un to attiecīgā atomu svara, simbola, blīvuma un elektronegativitātes secībai.
| Periodiskās sistēmas elementi ar atomu masu | |||||
|---|---|---|---|---|---|
| Atomu skaits | Ķīmiskā elementa nosaukums | Simbols | Atomu masa (amu) | Blīvums (g/cm 3 ) | Elektronegativitāte |
| 1 | Ūdeņradis | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Hēlijs | Viņš | 4,0026 | 0,0001785 | – |
| 3 | Litijs | Tas | 6 941 | 0,534 | 0,98 |
| 4 | Berilijs | Esi | 9.0122 | 1.85 | 1.57 |
| 5 | Bors | B | 10 811 | 2.34 | 2.04 |
| 6 | Ogleklis | C | 12.0107 | 2267 | 2.55 |
| 7 | Slāpeklis | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Skābeklis | O | 15.9994 | 0,001429 | 3.44 |
| 9 | Fluors | F | 18.9984 | 0,001696 | 3.98 |
| 10 | Neona | Jā | 20.1797 | 0,0009002 | – |
| vienpadsmit | Nātrijs | jau | 22.9897 | 0,968 | 0,93 |
| 12 | Magnijs | Mg | 24 305 | 1738 | 1.31 |
| 13 | Alumīnijs | Uz | 26,9815 | 2.7 | 1.61 |
| 14 | Silīcijs | Jā | 28.0855 | 2329 | 1.9 |
| piecpadsmit | Fosfors | P | 30,9738 | 1823 | 2.19 |
| 16 | Sērs | S | 32 065 | 2.07 | 2.58 |
| 17 | Hlors | Cl | 35 453 | 0,0032 | 3.16 |
| 18 | Argons | Ar | 39 948 | 0,001784 | – |
| 19 | Kālijs | K | 39,0983 | 0,89 | 0,82 |
| divdesmit | Kalcijs | Tas | 40 078 | 1.55 | 1 |
| divdesmitviens | Skandijs | Sc | 44,9559 | 2985 | 1.36 |
| 22 | Titāns | No | 47 867 | 4506 | 1.54 |
| 23 | Vanādijs | IN | 50,9415 | 6.11 | 1.63 |
| 24 | Chromium | Kr | 51,9961 | 7.15 | 1.66 |
| 25 | Mangāns | Mn | 54 938 | 7.21 | 1.55 |
| 26 | Dzelzs | Ticība | 55 845 | 7 874 | 1.83 |
| 27 | Kobalts | Co | 58,9332 | 8.9 | 1.88 |
| 28 | Niķelis | In | 58,6934 | 8908 | 1.91 |
| 29 | Varš | Ar | 63 546 | 1.9 | 60 |
| 30 | Cinks | Zn | 65.39 | 1.65 | 70 |
| 31 | Gallijs | Šeit | 69 723 | 1.81 | 19 |
| 32 | Germānija | Ge | 72.64 | 2.01 | 1.5 |
| 33 | Arsēns | Kā | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selēns | VIŅŠ | 78.96 | 2.55 | 0,05 |
| 35 | Broms | Br | 79 904 | 2.96 | 2.4 |
| 36 | Kriptons | NOK | 83 798 | 3 | 1×10–4 |
| 37 | Rubidijs | Rb | 85.4678 | 0,82 | 90 |
| 38 | Stroncijs | Sr | 87.62 | 0,95 | 370 |
| 39 | Itrijs | UN | 88 906 | 1.22 | 33 |
| 40 | Cirkonijs | Zr | 91 224 | 1.33 | 165 |
| 41 | niobijs | Nb | 92 906 | 1.6 | divdesmit |
| 42 | Molibdēns | Mo | 95.94 | 2.16 | 1.2 |
| 43 | Tehnēcijs | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Rutēnijs | Ru | 101.07 | 2.2 | 0,001 |
| Četri | Rodijs | Rh | 102.91 | 2.28 | 0,001 |
| 46 | Palādijs | Pd | 106.42 | 2.2 | 0,015 |
| 47 | Sudrabs | Plkst | 107.87 | 1.93 | 0,075 |
| 48 | Kadmijs | Cd | 112 411 | 1.69 | 0,159 |
| 49 | Indijs | In | 114.82 | 1.78 | 0.25 |
| piecdesmit | Tici | Sn | 118.71 | 1.96 | 23 |
| 51 | Antimons | Sb | 121,76 | 2.05 | 0.2 |
| 52 | Telūrs | The | 127.6 | 2.1 | 0,001 |
| 53 | Jods | es | 126.9045 | 2.66 | 0,45 |
| 54 | Ksenons | Automašīna | 131 293 | 2.6 | 3×10–5 |
| 55 | Cēzijs | Cs | 132.91 | 0,79 | 3 |
| 56 | Bārijs | Nav | 137 327 | 0,89 | 425 |
| 57 | Lantāns | The | 138.91 | 1.1 | 39 |
| 58 | Cerijs | Šis | 140.12 | 1.12 | 66.5 |
| 59 | Prazeodīms | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodīms | Nd | 144.24 | 1.14 | 41.5 |
| 61 | Prometijs | pm | 145 | 1.13 | 2×10–19 |
| 62 | Samarijs | Sm | 150.36 | 1.17 | 7.05 |
| 63 | Eiropijs | Eu | 151 964 | 1.2 | 2 |
| 64 | Gadolīnijs | Gd | 157.25 | 1.2 | 6.2 |
| 65 | Terbijs | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Disprozijs | Tie | 162.5 | 1.22 | 5.2 |
| 67 | Holmium | Uz | 164.9303 | 1.23 | 1.3 |
| 68 | Erbijs | Ir | 167 259 | 1.24 | 3.5 |
| 69 | Tulijs | Tm | 168,9342 | 1.25 | 0,52 |
| 70 | Iterbijs | Yb | 173.04 | 1.1 | 3.2 |
| 71 | Parīze | Lu | 174 967 | 1.27 | 0.8 |
| 72 | Hafnijs | Hf | 178.49 | 1.3 | 3 |
| 73 | Tantals | Sejas | 180,9479 | 1.5 | 2 |
| 74 | Volframs | IN | 183,84 | 2.36 | 1.3 |
| 75 | Rēnijs | Re | 186 207 | 1.9 | 7×10–4 |
| 76 | Osmijs | Tu | 190.23 | 2.2 | 0,002 |
| 77 | Iridijs | Un | 192.22 | 2.2 | 0,001 |
| 78 | Platīns | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Zelts | Plkst | 196,97 | 2.54 | 0,004 |
| 80 | Merkurs | Hg | 200.59 | 2 | 0,085 |
| 81 | Tallijs | Tl | 204.3833 | 1.62 | 0,85 |
| 82 | Svins | Pb | 207.2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismuts | Ar | 208.9804 | 2.02 | 0,009 |
| 84 | Polonijs | Pēc | 209 | 2 | 2×10–10 |
| 85 | Astatīns | Plkst | 210 | 2.2 | 3×10–20 |
| 86 | Radons | Rn | 222 | 2.2 | 4×10–13 |
| 87 | Francijs | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Rādijs | Sv | 226 | 0.9 | 9×10–7 |
| 89 | Aktīnijs | Un | 227 | 1.1 | 5,5 × 10–10 |
| 90 | Torijs | Th | 232.0381 | 1.3 | 9.6 |
| 91 | Protaktīnijs | Nu | 231.0359 | 1.5 | 1,4 × 10–6 |
| 92 | Urāns | IN | 238.0289 | 1.38 | 2.7 |
| 93 | Neptūns | Piem | 237 | 1.36 | ≤ 3×10–12 |
| 94 | Plutonijs | Varētu | 244 | 1.28 | ≤ 3×10–11 |
| 95 | Americium | Am | 243 | 1.13 | – |
| 96 | Kūrijs | Cm | 247 | 1.28 | – |
| 97 | Berķelija | Bk | 247 | 1.3 | – |
| 98 | Kalifornija | Sal | 251 | 1.3 | – |
| 99 | Einšteinijs | Ir | 252 | 1.3 | – |
| 100 | Fermijs | Fm | 257 | 1.3 | – |
| 101 | Mendeļejevs | Md | 258 | 1.3 | – |
| 102 | Cēls | Nē | 259 | 1.3 | – |
| 103 | Lorencijs | Lr | 262 | 1.3 | – |
| 104 | Rutherfordijs | Rf | 267 | – | – |
| 105 | Dubnijs | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrijs | Bh | 270 | – | – |
| 108 | Hasijs | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Rentgēnijs | Rg | 282 | – | – |
| 112 | Koperniks | Cn | 285 | – | – |
| 113 | Nihonijs | Nh | 286 | – | – |
| 114 | Flerovijs | In | 290 | – | – |
| 115 | Maskava | Mc | 290 | – | – |
| 116 | Livermorijs | Lv | 293 | – | – |
| 117 | Tenesīna | Ts | 294 | – | – |
| 118 | Oganesson | Un | 294 | – | – |
Svarīgi termini periodiskajā tabulā
| Noteikumi powershell mazāks par vai vienāds ar | Apraksts |
|---|---|
| Atomu skaits | Protonu skaitu, kas veido elementa kodolu, sauc par tā atomskaitli (Z). piem. Tad ogleklis satur 6 protonus, tāpēc tā atomu skaitam jābūt tikai 6. |
| Atomu masa | To definē kā elementa atomu vidējo masu. To mēra, pamatojoties uz elementa izotopu relatīvo dabisko pārpilnību. Atomu masa tiek saukts arī par atomsvaru (A). To mēra atomu masas vienībā (amu). |
| Periods | Periodiskās tabulas horizontālās rindas no kreisās uz labo pusi sauc par periodiem. Periodiskajā tabulā kopā ir 7 periodi. Elementi ir izvietoti horizontāli to īpašību līdzību dēļ, piemēram, vienas un tās pašas atomu orbitāles un tā tālāk. |
| Grupa | Periodiskās tabulas vertikālās kolonnas no augšas uz leju sauc par grupām. Periodiskajā tabulā kopā ir 18 grupas. Elementi ir izkārtoti vertikāli to īpašību līdzību dēļ, jo tajos ir vienāds valences elektronu skaits. |
| Elementa simbols | Simbols ir jēdziens, ko izmanto, lai attēlotu ķīmisko elementu, izmantojot burtu vai divu līdz trīs burtu kombināciju. piem. Oglekļa ķīmiskais simbols ir C, savukārt Fe tiek izmantots kā dzelzs un tā tālāk. |
Elementu klasifikācija periodiskajā tabulā
118 elementi ir sakārtoti 7 periodos un 18 grupās, kā parādīts iepriekš. Turklāt elementi ir sadalīti dažādos blokos.
| Bloķēt | Iekļautie elementi | Pēdējā aizpildīta elektronu apakščaula |
|---|---|---|
| s-bloks | 1. grupa (sārmu metāli) | s-apakščaula |
| 2. grupa (sārmzemju metāli) | ||
| p-bloks | 13. grupa (boru ģimene) | p-apakščaula |
| 14. grupa (oglekļa saime) | ||
| 15. grupa (slāpekļa saime) | ||
| 16. grupa (skābekļa ģimene) | ||
| 17. grupa (fluoru ģimene) | ||
| d-bloks | 3.–12. grupa (pārejas elementi) | d-apakščaula |
| f-bloks | Lantanīdi (retzemju elementi) | f-apakščaula |
| Aktinīdi |
Mendeļejeva periodiskā tabula
Lai attēlotu elementu uzvedības līdzības un tendences, Mendeļejevs izstrādāja periodisko tabulu, kas ir elementu izkārtojums augošā atommasu secībā tabulas veidā.

Saskaņā ar Mendeļejeva periodisko tabulu elementi tika sakārtoti atbilstoši to pamatīpašībām, atomu masai un ķīmiskajām īpašībām. Mendeļejeva darba laikā bija zināmi tikai 63 elementi. Mendeļejeva periodiskajā tabulā horizontālās rindas un vertikālās kolonnas tika attiecīgi sauktas par grupām un periodiem.
Tomēr Mendeļejeva periodiskā tabula neizdodas, jo tajā ir daudz trūkumu. Daži no tiem ir tādi, ka tajā nav izdevies apzīmēt ūdeņradi un cēlgāzes. Turklāt elementu atomu masas pieauguma secība nebija regulāra visā tabulā. Pat izotopu atklāšana pārkāpj Mendeļejeva periodisko likumu.
Lasīt vairāk:
- Mūsdienu periodiskā tabula
- Mendeļejeva periodiskā tabula
- Mūsdienu periodiskais likums
- Periodiskās tabulas vēsture
- Atomu struktūra
Bieži uzdotie jautājumi par elementu periodisko tabulu
Kas ir elementu periodiskā tabula?
Elementu periodiskā tabula ir ķīmisko elementu tabulas izkārtojums, kas sakārtots pēc to atomu skaita, elektronu konfigurācijas un atkārtotām ķīmiskajām īpašībām. Tabula ir sadalīta rindās, ko sauc par periodiem, un kolonnās, ko sauc par grupām vai ģimenēm.
Kurš atklāja elementu periodisko tabulu?
Periodisko elementu tabulu nav atklājis neviens cilvēks, bet tās izstrāde ir uzticēta krievu ķīmiķim Dmitrijam Mendeļejevam, kurš 1869. gadā sakārtoja elementus, pamatojoties uz to īpašībām.
Kas izveidoja mūsdienu periodisko tabulu?
1913. gadā Henrijs Mozelijs ieviesa atjauninātu periodiskās tabulas versiju, ko parasti dēvē par mūsdienu periodisko tabulu.
Kā tiek sakārtota periodiskā tabula?
Periodiskā tabula ir sakārtota pieaugošā atomu skaita secībā, elementi ir sagrupēti, pamatojoties uz līdzīgām ķīmiskajām īpašībām, un sakārtoti periodos (rindās) un grupās (kolonnās).
Kas ir atomskaitlis?
Protonu skaitu, kas veido elementa kodolu, sauc par tā atomskaitli (Z). piem. Tad ogleklis satur 6 protonus, tā atomu skaitam jābūt tikai 6.
Vai diviem dažādiem elementiem var būt vienāds atomskaitlis?
Neitronu skaits atomā no diviem dažādiem elementiem var būt līdzīgs, bet protonu skaits nekad nebūs vienāds. Katram elementam ir noteikts protonu skaits, kas atbilst atomu skaitam.
Kā aprēķināt atomu masu?
Atomu masu var aprēķināt, saskaitot elementā esošo protonu un neitronu masu.
Kas ir grupa periodiskajā tabulā?
Periodiskās tabulas kolonna attiecas uz periodiskās tabulas grupu. Tās pašas grupas elementiem ir līdzīgas fizikālās un ķīmiskās īpašības.
